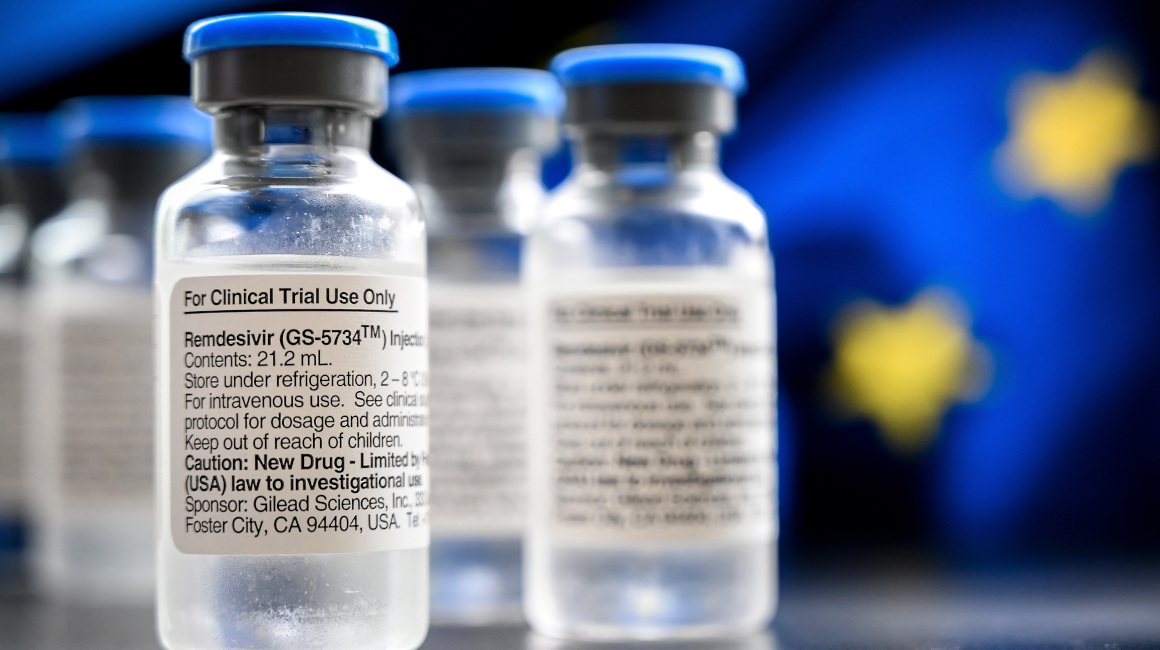
El día de hoy, La Comisión Europea autorizó provisionalmente la venta del medicamento antiviral “remdesivir” para el tratamiento de pacientes con COVID-19 en la Unión Europea (UE), después de la aprobación de la Agencia Europea de Medicamentos (EMA).
El ejecutivo comunitario adjudicó «una autorización de comercialización condicional para el medicamento remdesivir, convirtiéndolo en el primer medicamento autorizado a nivel de la UE para el tratamiento del COVID-19. “Concedemos esta autorización menos de un mes después de la presentación de la solicitud”, detalló Stella Kyeialides, comisaria europea de Salud.
La autorización de comercialización condicional se reserva en la UE a aquellos fármacos, cuyos beneficios se estiman mayores a sus riesgos, pese a no contar aún con datos completos. Su duración es de un año renovable.
¿Qué países autorizaron este medicamento?
Cabe detallar que, la molécula del laboratorio estadounidense Gilead Sciences fue desarrollada, principalmente para tratar a los pacientes con fiebre hemorrágica del ébola, sin éxito, pero durante un ensayo en Estados Unidos demostró cierta eficacia contra el COVID-19.
Según ese estudio, los pacientes con esta enfermedad y tratados con remdesivir se restablecen unos cuatro días antes que los otros enfermos. Estados Unidos y Japón autorizaron el uso del medicamento en casos de urgencia.
¿Quiénes están aptos para este tratamiento?
En su recomendación, previa a la autorización de la Comisión con la aprobación de los 27 países europeos, la Agencia Europea de Medicamentos (EMA) propuso su uso para adultos y adolescentes a partir de los 12 años que sufren de neumonía y necesitan oxígeno.
¿Qué es el remdesivir?
El Remdesivir es una terapia experimental que empezó a desarrollarse en 2009 y se puso a prueba con pacientes de ébola a mediados de la década pasada. Un ensayo clínico estadounidense detalló que se disminuye el tiempo de recuperación en algunos pacientes enfermos con el COVID-19.
Bruselas afirmó que los datos sobre el Remdesivir se analizaron «en un periodo de tiempo excepcionalmente corto mediante un procedimiento de revisión continua», dada la emergencia de salud pública que supone el coronavirus.“Esto ha permitido conceder la autorización con rapidez en el contexto de la crisis del coronavirus, en el plazo de una semana tras la recomendación de la EMA, comparado con los 67 días habituales” , recalcó.
«La autorización de hoy de un primer medicamento para tratar el COVID-19 es un importante paso adelante en la lucha contra este virus», enfatizó la comisaria europea de Salud, Stella Kyriakides.